Un nouvel instrument analytique à la pointe de la recherche accueilli à l’IGE

L’ERC DOC-PAST cherche à établir les liens de causalité entre les fluctuations climatiques passées et l’état chimique de l’atmosphère au moyen des carottes de glace. Comment ces deux composantes interagissent entre elles dans le passé reste l’un des derniers mystères de la machine climatique terrestre (GIEC AR6, Chap. 6). La raison est que l’état chimique est déterminé par des agents oxydants de l’atmosphère très instables et à très courte durée de vie qui ne sont archivés d’aucune manière dans la glace. Dès lors comment remonter l’horloge du temps ? Et bien il faut aller sonder la matière archivée dans la glace au niveau atomique, c’est-à-dire voir comment les éléments et leurs isotopes s’agencent dans une molécule car cette organisation est le fruit des agents oxydants.
Dans le cadre de cette ERC (Conseil européen de la recherche), l’IGE et plus particulièrement la plateforme PANDA de l’équipe de recherche ICE3 s’équipe du tout nouveau Orbitrap-Isotope de chez ThermoFisher Scientific. Après une mise en service en Octobre 2022 et sa prise en main durant les semaines suivantes, l’instrument est aujourd’hui opérationnel.
Mais qu’est-ce qu’un Orbitrap et de surcroit en version isotope ?
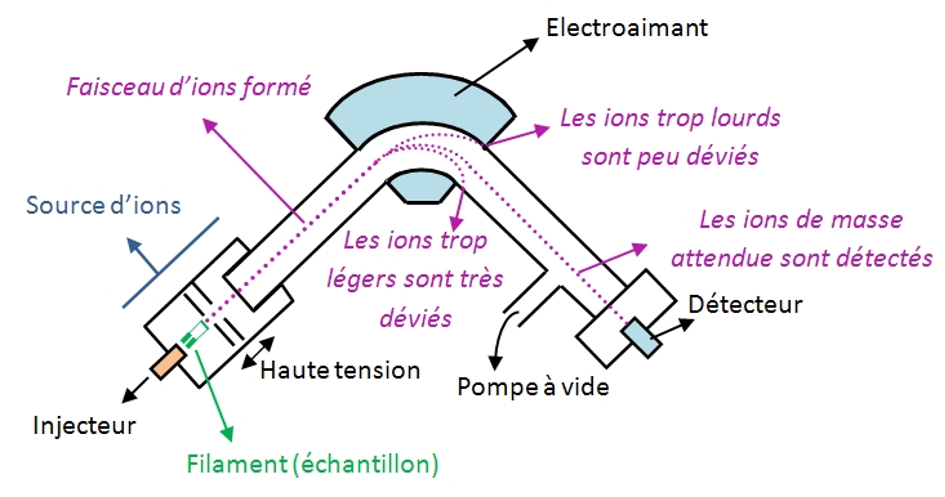
Historiquement l’analyse des isotopes stables de la matière (13C, 15N, 18O etc.) s’effectue sur des spectromètres de masse à secteur magnétique. Des molécules cibles contenant les isotopes à quantifier sont introduites dans une chambre à vide où elles vont être ionisées par impact électronique. Les ions sont accélérés par une haute tension, focalisés, puis injectés dans un secteur magnétique qui va dévier les faisceaux ioniques selon le rapport masse sur charge, m/z. C’est ainsi que les isotopologues (substances qui ne se différencient que par leurs contenu isotopique) sont séparés (Figure 1). Par exemple, si du N2 est introduit dans le spectromètre de masse, les isotopologues 14N14N, 14N15N, 15N15N sont séparés. Les intensités de courant de ces faisceaux sont alors mesurées et leur rapport permet d’accéder aux rapports isotopiques usuels (18O/16O, 15N/14N, 13C/12C etc.) exploités en climatologie comme en géochimie car représentatifs de l’origine de la matière.
C’est sur ce principe que la quasi-totalité des isotopes a été découverte, principe n’ayant guère changé depuis les années 1920. Cependant, ce principe se heurte à deux limitations fondamentales. La première est le pouvoir de séparation (ou résolution en masse : m/∆m). Celui-ci dépend de la longueur du chemin parcouru après le champ magnétique. Très vite la taille de l’instrument devient une contrainte majeure et les instruments actuels atteignent difficilement des résolutions en masse supérieures à 2000 (possibilité de séparer des masses situées à des valeurs m/z de 2000 et 2001 ou de 200 et 200,1 ou de 20,00 et 20,01). Cette faible résolution ne permet pas de séparer par exemple N2 et CO ou 13C16O et 12C17O qui ont une masse très proche. La conséquence directe de cette limitation de résolution est de contraindre l’utilisateur à manipuler des composés purs et simples pour éviter ces interférences massiques. Par exemple il n’est pas possible de mesurer le rapport 13C/12C directement sur le méthane (interférence du deutérium), il faut passer par une transformation chimique pour le convertir en CO2, ce qui génère beaucoup de manipulation et transformation en amont. De même les composés non volatils comme le nitrate nécessitent de multiples étapes de transformation pour obtenir le gaz cible qui sera introduit dans le spectromètre de masse. Le deuxième point limitant qui découle en partie du premier est la faible sensibilité des spectromètres de masse. Il faut beaucoup de matière pour effectuer une analyse car peu de molécules sont ionisées, environ 1 sur 1000 et encore moins si l’on fait des transformations chimiques en amont.
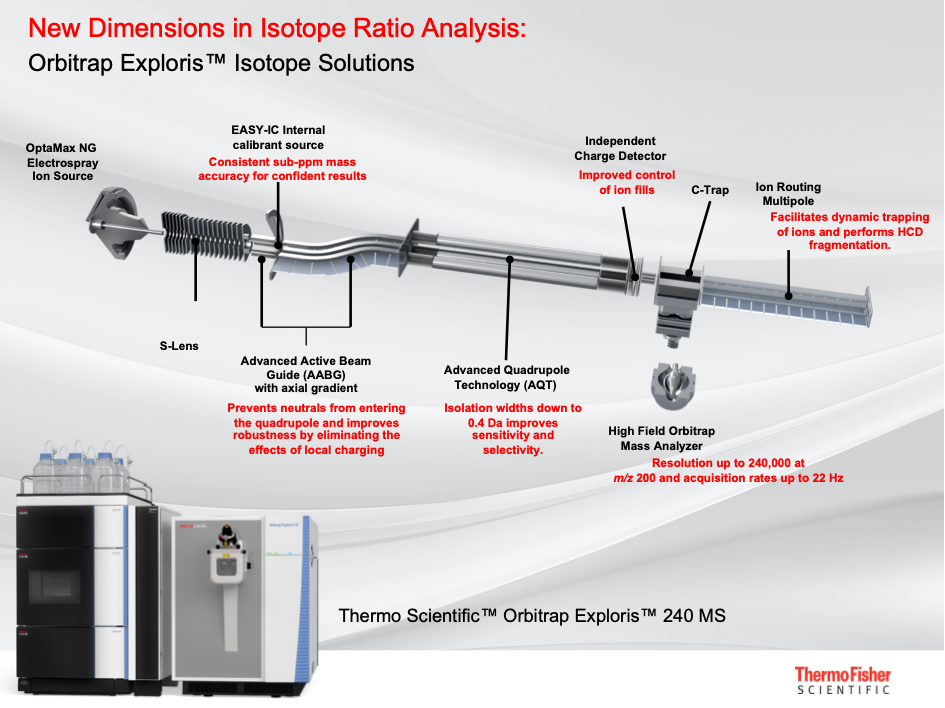
L’orbitrap est aussi un spectromètre de masse mais qui fonctionne sur un principe complétement différent (Figure 2).
Dans un premier temps les molécules contenues dans une solution liquide sont pulvérisées en fines gouttelettes de taille nanométriques à pression atmosphérique. Une haute tension charge ces gouttelettes, lesquelles en se vaporisant transfèrent la charge électrostatique aux composés dissous dans la solution. L’ionisation est douce et quasi-totale, augmentant la sensibilité d’un facteur 100 par rapport aux spectromètres traditionnels. Ce n’est plus un litre d’échantillon de glace qui est nécessaire mais seulement 10 ml pour effectuer la même analyse ! À ce stade le faisceau d’ions contient toute sorte de composés ionisés. Ici, point de purification au stade de l’introduction de l’échantillon, c’est dans le cœur de la machine que la sélection s’opère. Une fois le faisceau guidé et focalisé, un premier filtre permet de sélectionner une fenêtre de masse d’intérêt. Le paquet d’ions sélectionné est alors introduit dans un oscillateur électrostatique, où les ions vont osciller entre deux électrodes. A l’intérieur de cet oscillateur, les ions se séparent et adoptent une fréquence d’oscillation (entre la centaine de kHz aux MHz) qui ne dépend que du rapport m/z. Une transformée de fourrier permet alors de passer d’un spectre en fréquence à un spectre en masse. Ce principe permet d’atteindre des résolutions massiques de 1 000 000 ! Plus on observe, plus on augmente la résolution en masse. Tout est ensuite question de compromis entre le souhaitable et le praticable. Cette exceptionnelle résolution en masse permet à cet instrument de déterminer la composition chimique de molécules inconnues composées de plusieurs centaines d’atomes, la précision en masse étant connu à 10-6 unité de masse ! Avec de telles performances, plus besoin de « préparer » l’échantillon en amont, de manipuler de grosses quantités d’échantillon ou d’avoir un composé pur en solution.
Cerise sur le gâteau, la plupart des isotopologues d’un composé sont résolus en masse, les interférences massiques habituelles des spectromètres de masse disparaissent, permettant à cet instrument de mettre un pied dans le domaine des isotopes stables. Le tableau 1 montre les capacités de l’orbitrap-isotope pour le sulfate et le nitrate, avec en rouge ce qui est quantifiable.
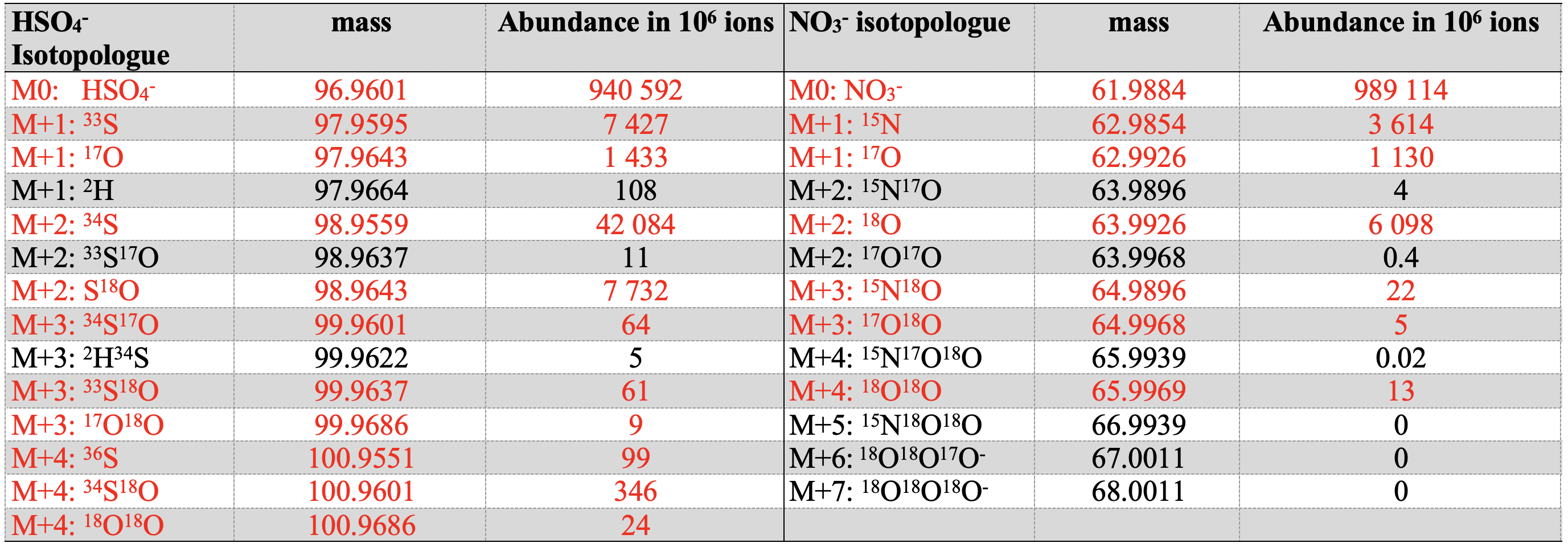
En résumé, l’Orbitrap permet d’utiliser 100 fois moins de masse d’échantillon, d’éviter les conversions chimiques et procure des rapports isotopiques moléculaires et non plus atomiques, enrichissant d’autant le nombre de rapports mesurés. Par exemple, ce n’est plus 3 rapports isotopiques que l’on mesure pour le nitrate mais 6 rapports d’isotopologues M+1/M0 à M+4/M0, ce qui inclut les isopotologues doublement substitués (15N18O16O16O par exemple). La fiche « signalétique » du composé mesuré s’enrichit tout comme la capacité à comprendre comment les molécules se forment.
Cet équipement est financé dans le cadre du programme ERC Advanced Grant DOC-PAST (GA101054558).
Ressources
Vidéo du constructeur montrant le principe de base du fonctionnement d’un Obitrap
À comparer avec celui d’un spectromètre de masse standard
Vidéo : How a Stable Isotope Ratio Mass Spectrometer works
Auteur : J. Savarino - 20/03/2023

 La fédération
La fédération Intranet
Intranet